SỰ TƯƠNG TÁC GIỮA LASER VÀ MÔ CƠ THỂ( Phần I)
TÍNH CHẤT QUANG HỌC CỦA MÔ
Để hiểu được các hình thức tương tác khác nhau giữa mô và laser, chúng ta cần có cái nhìn tổng quát về cách mà các photon tương tác với mô cũng như tính chất vật lý hình thành nên các tương tác đó. Khi các photon tiếp xúc với bề mặt mô, vì sự thay đổi chỉ số khúc xạ, một lượng (khoảng 4-10%) các photon sẽ bị phản xạ trở lại theo góc tới. Các photon xâm nhập được qua bề mặt mô sẽ bị khúc xạ theo định luật Snellius – là hiện tượng xảy ra khi tia sáng đi từ môi trường chiết suất thấp sang môi trường có chiết suất cao theo trục thẳng đứng vuông góc với bề mặt (Hình 1). Chỉ số khúc xạ của mô là khoảng 1.4 theo định luật Snellius.
Bên trong mô, các photon có thể bị phân tán, chuyển hướng theo các yếu tố không định hướng kết quả là hoặc sẽ được hấp thu hoặc sẽ kích thích phân tử hấp thu phóng thích điện tử.
Hấp thu
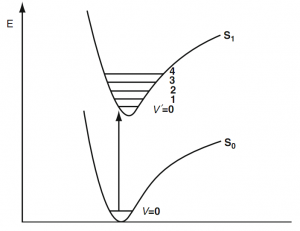
Các trạng thái năng lượng của phân tử được xác định; do đó, sự hấp thu một photon chỉ xảy ra khi mà năng lượng của nó E= hn phải tương ứng với năng lượng khác biệt giữa các mức năng lượng.
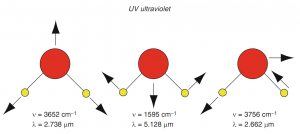
Sự hấp thu của một photon bởi một nhóm mang màu được gây ra bởi sự thay đổi về khoảng cách giữa các điện tử (chuyển đổi electron, tia cực tím…) (hình 2) hoặc một điện tử chuyển động quanh phân tử (thay đổi chuyển động, NIR, hình 3).
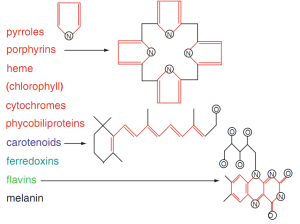
Các phân tử trong mô có thể hấp thu photon như là porphyrin, hemoglobin, melanin, flavin, retinol, acid nucleic, deoxyribonucleic acid (DNA), ribonucleic acid (RNA) và nicotinamide adenine dinucleotide, nơi mà các điện tử electron sẽ bị kích thích, dẫn đến sự thay đổi dải hấp thu rời rạc và tăng cường. Trong vùng hồng ngoại gần và hồng ngoại trung phụ thuộc vào sự hấp thu nước với tối đa là tại 3µm. Hệ số µ đặc trưng cho sự hấp thu. Nghịch đảo lại, hệ số l xác định độ sâu có thể xâm nhập được trong môi trường hấp thụ.
Để hiểu về cơ chế của hấp thu, người ta có thể hình dung ra một nhóm mang màu với một mặt cắt ngang hình học kích thước A (cm2) được đặt trong một chùm tia sáng laser song song (hình 4). Phần bóng được tạo ra chính là phần hiệu quả cuả tia sáng, thường thì nó sẽ nhỏ hơn mặt cắt ngang bình thường của tia sáng. Khi có nhiều nhóm mang màu với mật độ ra (cm-3) thì hệ số hấp thu được tính bằng công thức: µa=rasa (cm-1).
Các nhà hóa học thường sử dụng định luật Beer để tính lượng tia sáng truyền qua 1 cái cuvet chiều ngang d, chứa đầy dung dịch hấp thu. Sau đó, biểu thức trở thành:
T = I / I0 = 10-ecd = 10-r
Trong đó:
e: hệ số mol viết tắt [L/mol.cm]
c: nồng độ [mol/L]
d: bề dày của vật đựng (cm)
r: mật độ quang học
Trong vật lý, công thức lại được chuyển thành:
T = I / I 0 = exp(-sa Nal) = exp(-mal ),
Trong đó:
sa: diện tích hấp thu hiệu quả (cm2)
Na: mật độ các phân tử hấp thu (cm-3)
l: bề dày của vật đựng (cm)
ma: hệ số hấp thu (cm-1)
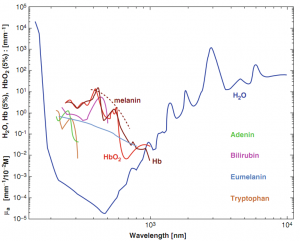
Hình ảnh quang phổ hấp thu của các mô sinh học khác nhau và nước được thể hiện trong hình 5.
Tán xạ
Tán xạ cũng là một tương tác quan trọng trong các tương tác giữa ánh sáng và mô sinh học vì nó quyết định cường độ ánh sáng của ánh sáng trong mô. Đây là bước cơ bản trong quá trình tương tác mô theo sau hấp thu và tỏa nhiệt. Sự tán xạ của một photon đi kèm với sự thay đổi hướng truyền mà không mất năng lượng. Tán xạ có thể xảy ra ở các cấu trúc lớn như sợi cơ, lớp da, tủy răng; cấu trúc nhỏ như tế bào, trong tế bào thậm chí là vi phân tử hoặc nano.
Tùy theo kích thước mà người ta phân loại thành tán xạ Rayleigh d<<1 và tán xạ Mie d≥1. Sự tán xạ trong mô cơ thể luôn là kết hợp của tán xạ Rayleigh và tán xạ Mie (hình 1) phụ thuộc vào cấu trúc mà nó tiếp cận. Tán xạ Raylegh là tán xạ đẳng hướng, chỉ phụ thuộc vào sự phân cực và bước sóng.
Tán xạ Mie, khu vực gần cũng như xa có thể được tính toán chính xác với mô hình Monte Carlo (MCS). Mô phỏng tán xạ này được thể hiện rõ trong hình 2 ví dụ về tán xạ của một giọt nước 10nm ở bước sóng 650nm. Do kích thước lớn, hình ảnh tán xạ được lấy từ nhiều vị trí khác nhau. Điều này dẫn đến cực đại cường độ sẽ đo được khi biết được góc tán xạ. Sự tán xạ, tương tự như sự hấp thu được thể hiện bởi chỉ số tán xạ µs(cm-1). Nghịch đảo 1/ µs(cm) cho biết chiều dài quãng đường trung bình mà một tán xạ tiếp theo sẽ xảy ra. Như vậy, khi nói ánh sáng đỏ ở da người có chỉ số hấp thu là 50µm có nghĩa là chiều dài tán xạ là 5mm. Điều đó cũng có nghĩa là một photon tán xạ 100 lần đến khi chúng được hấp thu.
Tán xạ Mie là tán xạ không đẳng hướng. Thay đổi hướng là yếu tố nổi bật trong các mô sinh học. Đặc điểm này được mô tả bởi các yếu tố không đẳng hướng (g). G có thể có giá trị tuyệt đối từ 0 đến 1, từ tán xạ đẳng hướng (g=0) đến tán xạ không đẳng hướng (g=1). Giá trị âm có thể kể đến các phản xạ ngược. Trong mô, g có gía trị khoảng từ 0.8 đến 0.99.
Lúc này công thức của chỉ số tán xạ được điều chỉnh thành:
Trong các MCS, người ta cần xem xét một hàm xác suất cho g để xác định hướng của photon bị tán xạ. Hàm Henyey-Greenstein p(θ) thường được sử dụng để xác định góc của ánh sáng bị tán xạ bởi mô. Góc trung bình đảm bảo điều kiện cosine <cos θ> góc tán xạ θ.
Tham số g phân phối bình thường, với mỗi giá trị của g, hình 3 cho thấy giá trị của θ trong khoảng -180o ≤ θ ≤ +180o . Khi g tiến gần đến 1, θ sẽ tiến tới 0. Trong trường hợp tán xạ đẳng hướng, g=0, p(θ) sẽ là 1/4π ở mọi giá trị của θ.
Khi lấy tổng µs và µa ta có hệ số tán xạ suy giảm µt
Đo hằng số quang học của các mô sinh học không phải là một việc đơn giản. Trong một cấu trúc nơi một chùm tia chuẩn trực đến một mô có độ dày xác định và chỉ có một số photon truyền qua được đến với detector, chỉ số tán xạ suy giảm có thể được đo lường.
Nhìn chung, chỉ số quang học của các mô sinh học như µa, µs và g khó mà đo lường trực tiếp được mà cần có các quá trình đánh giá và đo lường phức tạp. Khi đặt một lát mô giữa hai quả cầu tích hợp (Ulbricht spheres), từ đó tồng số bức xạ truyền qua có thể đo lường được. MCS giúp xác định chính xác các thông số quang học của các tương tác lặp đi lặp lại.
Một số các trình bày khác giúp ích trong việc mô tả các tính chất quang học của mô sinh học. Hệ số tán xạ khi so với tổng hệ số tán xạ suy giảm gọi là Albedo a:
Albedo a = µs(µs + µa)
Trong khi đó hiệu quả của sự suy giảm được định nghĩa là:
µeff = (3µa(µa + µs’))1/2 (cm-1)
Giá trị nghịch đảo 1/µ, được gọi là độ sâu thâm nhập hiệu quả, d của ánh sáng vào mô:
deff = 1/µeff (cm)
và hiệu quả không phụ thuộc vào bề dày Xeff được tính theo công thức:
Xeff = 1/( µa + µs’) [cm]
Công thức
mô tả tỷ lệ ánh sáng hay mật độ photon được vận chuyển qua một khoảng cách d. Photon có thể được truyền đi mà không phải qua bất cứ quá trình gì hoặc là trải qua rất nhiều lần bị tán xạ. nếu các tán xạ chủ yếu là tiến về phía trước thì hệ số tán xạ truyền qua µs’ sẽ nhỏ hơn µs. Một photon để có thể đến được detector có thể phải đi qua một đoạn đường dài (nhiều lần tán xạ) hơn d.
Mật độ photon được hấp thụ vào trong mô cũng có thể được thể hiện qua chỉ số khuyếch tán:
Với chỉ số khuếch tán D,
Mặc dù các giải pháp phân tích vẫn chưa được công bố, tuy nhiên ánh sáng được hấp thu bởi các mô sinh học hoàn toàn tồn tại. Do đó, trong hầu hết các trường hợp, MCS được sử dụng để các định sự phân bố của các photon trong mô. Chương trình có thể download miễn phí trên internet.
MCS cũng được sử dụng trong các mô hình tương tác laser – mô. Một ví dụ đã được công bố bởi Romero và các đồng sự.
Quyết định lựa chọn mô hình phù hợp để tính toán lượng photon phân bố và được hấp thu vào trong mô phụ thuộc vào giá trị µa và µs. Một số trường hợp đáng chú ý như sau:
µa >> µs’: định luật Lambert – Beers’ (l<300 nm và l >2,000 nm)
µa << µs’: chỉ số xấp xỉ được chấp nhận (650 nm<l< 1,150 nm
µa µs’: áp dụng phương trình MSC (300 nm < l< 650 nm; 1,150 nm < l< 2,000 nm).
Bảng 1 tóm tắt các độ sâu thâm nhập của các mô ở các bước sóng laser khác nhau. Sự hấp thu và hiệu quả truyền qua được coi là không phụ thuộc vào con đường
| Bước sóng (nm) | Độ sâu thâm nhập (1/ma[mm])
a |
Hiệu quả thâm nhập (1/meff [mm]) |
| 193 | »10 | »1 |
| 308 | 50 | 6 |
| 532 | 830 | 240 |
| 1.064 | 2.500 | 1.900 |
| 2.060 | 286 | 250 |
| 2.940 | 3 | 3 |
| 10.600 | 17 | 17 |
Có thể đo lường được sự phân bố ánh sáng trong các mô bằng một thiết bị thăm dò có đường kính khoảng 100µm được đưa vào trong mô bằng khoảng rỗng bên trong kim. Kết quả xác nhận lý thuyết cho rằng mật độ ánh sáng trực tiếp bên dưới bề mặt tế bào được tăng cường bởi từ 2-4 yếu tố khi so với cường độ của tia tới. Sự tăng cường này có thể là do hiện tượng tán xạ chồng chéo của các photon tới. Một nhận định khác nữa là trong tán xạ, hiệu quả xâm nhập mô của photon còn phụ thuộc vào khu vực chiếu xạ. Do đó, độ sâu thâm nhập sẽ tăng gấp dôi nếu cùng một khu vực chiếu xạ, đường kính của hình ảnh chiếu xạ tăng từ 1 đến 5mm. Đối với các ứng dụng trong da liễu, hiệu ứng này rất đáng chú ý.
TƯƠNG TÁC VỚI QUÁ TRÌNH CHUYỂN HÓA
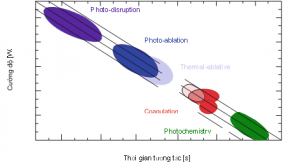
Bài công bố về sự tương tác của tia laser lên quá trình chuyển hóa của mô sinh học được trình bày đầu tiên bởi Boulnois vào năm 1986 (hình 1). Một phát hiện quan trọng là nguyên lý ly giải quang nhiệt chọn lọc (SP) bởi Anderson và Parish vào năm 1983. SP mô tả sự tác động lên cấu trúc mô sinh học một cách chọn lọc bởi bước sóng, thời gian xung và độ lặp lại. Trong phần sau đây, chúng ta sẽ tìm hiểu một số loại tương tác giữa laser và mô khác nhau.
TÁC DỤNG NHIỆT, HÓA HỌC
Khi chiếu xạ liều thấp vào mô sống, photon có thể ảnh hưởng đến sự phát triển của các tế bào. Nhiều giả thuyết đã được công bố trong quá khứ về sựu tương tác của các photon (630 nm với laser helium-neon haowjc 820nm ở laser diode) với nhưng nghiên cứu trong ống nghiệm và quá trình lành vết thương bởi các tác nhân sinh học. Hầu hết các kết quả chưa được xác nhận hoặc là vẫn cần nghiên cứu thêm những điều kiện khác.
Kích thích sinh học
Giả thuyết rằng năng lượng của photon khi được hấp thu vào tế bào hoặc mô có thể ảnh hưởng đến quá trình trao đổi chất và đường truyền tín hiệu được chấp nhận. Giả thuyết này được kiểm chứng bởi Hawkins-Evans và Abrahamse.
Các phân tử mục tiêu có thể là các cytochrome oxidase (với sự hấp thu ánh sáng gần hồng ngoại) hoặc porphyrin. Đối với tê sbafo, mục tiêu tác động là ty thể với việc tăng cường sản sinh adenosine triphosphat, các phản ứng oxy hóa và các tín hiệu tế bào như minh họa trong hình 2.
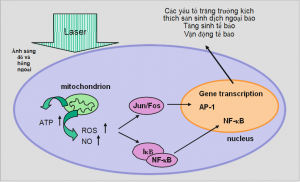
Các kết quả có thể là:
- Tăng sinh tế bào và di chuyển (đặc biệt là nguyên bào sợi)
- Điều tiết các cấp độ của cytokin, các yếu tố tăng trưởng và các yếu tố trung gian gây viêm.
- Ảnh hưởng đến các hoạt động của các chất truyền tin thứ 2 (cyclin adenosin, monophosphat, Ca2+, nitric oxid)
- Tăng sinh oxy mô
- Tăng sinh oxy mô
- Thúc đẩy quá trình làm lành vết thương và cải thiện tình trạng tổn thương, giảm đau và các tác động lên thần kinh.
Trong tất cả các trường hợp, liều ánh sáng cần phải được lựa chọn cần cân nhắc cẩn thận vì ánh sáng không phải lúc nào cũng tốt. Phần quang phổ thường cho kết quả cao nhất nằm trọng khoảng 633, 690, 820 và 900nm.
Quang động học
Liệu pháp quang động học sử dụng một phản ứng quang hóa với 3 thành phần: ánh sáng để kích hoạt, chất nhạy cảm với ánh sáng và oxy phân tử. Các chất nhạy cảm với ánh sáng được đưa vào các tế bào mục tiêu. Chứng hấp thu năng lượng từ ánh sáng và bị kích hoạt. Sau khi năng lượng được chuyển đổi từ dạng singlet sáng dạng triplet, phần năng lượng đó sẽ chuyển đổi phân tử oxy sang dạng bị kích hoạt. chính dạng phân tử này sẽ phá hủy tế bào mục tiêu. Liệu pháp gây độc tế bào này được sử dụng để điều trị các khối ú cũng như các tình trạng tiền ung thư hoặc các tổn thương ác tính. Các chất nhạy cảm với ánh sáng cũng là các chất phát quang. Vì vậy chúng còn được dùng để chẩn đoán khối u bằng hình ảnh như là các tình trạng khối u giai đoạn đầu. Liệu pháp quang động học sẽ được đề cập nhiều hơn trong những bài viết sau.
Dưới đây là hình minh họa liệu pháp này với sự phụ thuộc của quá trình điều trị vào nồng độ thuốc, độc tính của thuốc, sự tiếp xúc với bức xạ laser và việc cung cấp oxy đầy đủ. Do đó, biện pháp đo lường là rất quan trọng cho một liệu trình điều trị thành công là phải kiểm soát tất cả các thông số này, đặc biệt là ở các lớp sâu hơn của mô. Nồng dộ của chất nhạy cảm tích tụ trong mô đích và hình ảnh của bức xạ có thể được diều chỉnh bằng cách tăng hoặc giảm cường độ quang hóa.





