BỆNH LÝ VỀ DA LIÊN QUAN ĐẾN THẬN (Phần II)
Bệnh xơ hóa hệ thống do thận (NSF)
NSF là một rối loạn xơ cứng xảy ra ở bệnh nhân bệnh thận mạn, ghép thận hoặc bị tổn thương thận cấp tính. Tình trạng này được đặc trưng bởi sự xơ hóa tiến triển và dày lên của da, đôi khi có sự tham gia của các cơ quan và mô khác như phổi, tim, gan, thực quản, tinh hoàn, cơ vân và cơ trơn. Các ca bệnh đầu tiên của NSF được báo cáo vào năm 1997, hiện nay đã đăng ký quốc tế 80 ca trong khi có hơn 215 trường hợp được xác nhận. Tình trạng này có thể xảy ra trên tất cả các sắc tộc và tỷ lệ ngang bằng đối với nam và nữ.
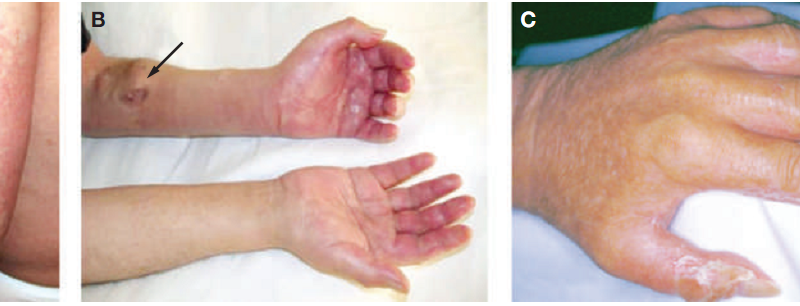
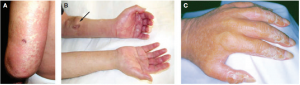
Thông thường, các bệnh nhân NSF ban đầu khó chịu bởi sự kéo căng và sưng vù của da ở các chi trên, dưới với nhưng nốt đỏ sáng, tối khác nhau. Các tổn thương hình thành đối xứng trên mắt cá chân, bắp chân, cổ tay hoặc cẳng tay dưới hình thức các nốt sần, mụn đỏ, mụn bọc. Sau khoảng vài ngày hoặc vài tuần, các tổn thương sẽ diễn tiến thành những mảng hồng ban, da trở nên dày lên và trở nên sần sùi như vỏ cam, tình trạng tiến triển nặng có thể hạn chế việc di chuyển của các khớp nối gần đó dẫn đến teo cơ và liệt (hình 5). Các tổn thương có thể mở rộng, thường là ở phần đầu nhưng thỉnh thoảng ở tay và chân với tình trạng sưng tiến triển. Bệnh nhân có thể phàn nàn về cảm giác đau, căng da ở các chi, khớp; đôi khi cảm thẩy ngứa, nóng rát và yếu cơ. Mặc dù NSF không trực tiếp gây ra tử vong, nhưng nó làm suy nhược cơ thể, có thể gây ra các biến chứng thứ phát kéo dài thời gian nằm viện và tỷ lệ tử vong lên đến 30%. Các yếu tố được báo cáo có liên quan đến NSF (chưa có bằng chứng) bao gồm rối loạn đông máu (vd: tăng cường đông máu), mới phẫu thuật mạch máu, huyết khổi tĩnh mạch sâu, ghép thận không thành công hoặc không hiệu quả, bệnh gan, tăng phosphat huyết và sử dụng liều cao erythropoietin. Mặt khác, các thuốc ức chế men chuyển-angiotensin có thể bảo vệ cơ thể, chống lại NSF. Erythropoietin liều cao có thể làm tăng số lượng các tế bào gốc tạo máu và có thể gây ra sự quá mức, đáp ứng làm lành vết thương và sản sinh fibrin; những tình trạng này có thể xảy ra đồng thời. Sử ụng chất phản xạ nhóm gadolinium trong MRI cũng liên quan đến sự tiến triển NSF ở bệnh nhân bệnh thận mạn.
 |
|
Hình 5. NSF ở bệnh nhân 56 tuổi (A) Mẫn đỏ, da dày vỏ cam ở cánh tay (B) Khuyết khổi thứ phát ở cánh tay bên trái (C) Tay phải của bệnh nhân bị giới hạn hoạt động tại các khớp |
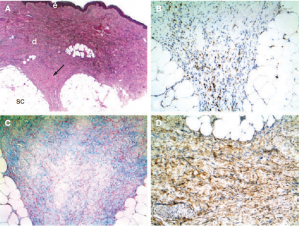
Chẩn đoán NFS dựa trên tiền sử bệnh, khám thực thể và xác định bằng sinh thiết da (hình 6). Chẩn đoán mô học cho thấy lớp trung bì dày lên với những thay đổi về bệnh học bao gồm sự gia tăng các tế bào hình thoi với sự lắng đọng mucin kẽ, sự có mặt của các bó collagen và sự thiếu hụt các tế bào viêm. Đồng thời có sự xuất hiện của tế bào tua và mô bào. Các tế bào hình thoi dương tính với CD34 và procollagen I và được cho là có nguồn gốc từ sự lưu thông các tế bào liên kết của cả CD34 và procollagen I. Trong một số trường hợp có sự vôi hóa di căn và thậm chí hóa thành xương. Scan PET toàn thân bằng 18F-florodeoxy-glucose cho thấy hoạt động trao đổi chất tăng lên ở các khu vực bị tổn thương lâm sàng. Kỹ thuật này được sử dụng để xác nhận sự thay đổi tình trạng viêm liên quan đến NSF và các lý thuyết được dùng để đánh giá đáp ứng của các liệu pháp.
 |
|
Hình 6. Hình ảnh mô học của tình trạng NSF (A) Nhuộm H&E cho thấy sự dày lên của lớp trung bì Mũi tên chỉ một vách ngăn sợi giữa các túi chất béo của lớp mỡ dưới da (B) Nhuộm miễn dịch CD68 cho thấy hình ảnh các đại thực bào. (C) Nhuộm xanh Alcian cho thấy lắng động mucin. (D) Nhuộm miễn dịch CD34 – thấy các nguyên bào sợi hình thoi. |
Điều trị
Hiện tại, NSF chưa được điều trị hiệu quả. Nhiều báo cáo công bố các giải pháp y khoa khác nhau nhưng chưa có bằng chứng nào thuyết phục. Các liệu pháp đã được kiểm tra bao gồm: corticosteroid, thalidomide, cyclophosphamide, sirolimus, ciclosporin, immunoglobulin, canxipotrene dạng thoa tại chỗ, psoralen và liệu pháp tia UVA, interferon γ, natri thiosulfate, phân tách huyết tương, imatinib mesylate, liệu pháp quang hóa ngoài cơ thể (extracorporeal photopheresis) (sau khi kiểm tra bằng 8-methoxypsoralen). Trong trường hợp NSF có liên quan đến tổn thương thận thì phục hồi chức năng là mục tiêu chính. Vật lý trị liệu, xoa bóp mô sâu và bơi được khuyến cáo ở tất cả các bệnh nhân NSF để duy trì vận động và ngăn ngừa sự liệt cơ.
Hiện nay, phòng ngừa NSF là quan trọng hơn bất cứ can thiệp nào, tăng cường nhận thức cũng cần được lưu ý. Sử dụng các chất cản quang gadolinium được giới hạn ở mức tối thiểu trên bệnh nhân bệnh thận mạn; các chất cản quang iod có độ thẩm thấu thấp hoặc đẳng trương là lựa chọn thay thế hợp lý cho các chất trên trong hầu hết các trường hợp.
Một số chiến lược dự phòng được đề xuất để ngăn ngừa bệnh thận do các chất cản quang phóng xạ gây ra, nhưng những phương pháp này không phải lúc nào cũng có hiệu quả. Trong trường hợp cần kiểm tra bằng các chất cản quang gadolinium, nên dùng các liều thấp và những loại ổn định như gadobenate dimeglumine.
Chất cản quang gadolinium có thể bị loại bỏ bằng thẩm phân máu (92% sau 2 lần chạy thận, 99% sau ba lần). Vì vậy, chiến lược này có thể áp dụng ở những bệnh nhân bệnh thận mạn giai đoạn 4,5 cần MRI với chất cản quang gadolinium. Tuy nhiên, không có nghiên cứu nào cho thấy lợi ích lâm sàng của thẩm phân máu trong việc ngăn ngừa NSF. Một phân tích hồi cứu được công bố năm 2008 cho thấy thẩm phân máu giúp ngăn ngừa NSF ở những bệnh nhân có tỷ lệ lọc cầu thận dưới 15ml/phút/1,73m2 những người sử dụng chất cản quang gadolinium liều cao. Xét nghiệm phúc mạc không hiệu quả trong việc loại bỏ gadolinium. Những bệnh nhân bệnh thận mạn giai đoạn 4 hoặc 5 nên được thông báo về những lợi ích và rủi ra khi sử dụng chất cản quang gadolinium trong chẩn đoán. Chưa có hướng dẫn được thống nhất khi dùng chất cản quang gadolinium cho bệnh nhân bệnh thận mạn giai đoạn 3 nhưng tránh dùng các chất cản quang tuyến tính, không ion và gadolinium. Việc chạy thận nhân tạo sau khi tiếp xúc có lợi cho nhóm bệnh nhân bệnh thận mạn giai đoạn 4,5 này hay không vẫn chưa được rõ ràng.
Bệnh Kyrle (bệnh thủng da mắc phải – Acquired Perforating Dermatosis – APD)
Căn bệnh này xuất hiện ở 15% số bệnh nhân chạy thận nhân tạo và xảy ra chủ yếu ở người Mỹ gốc Phi và các bệnh nhân tiểu đường. APD cũng liên quan đến các bệnh thực thể khác như bệnh gan, bệnh tuyến giáp, u ác tính, ghẻ lở và AIDS. APD được đặc trưng bởi các u cục với cách sắp xếp thành hình vỏ sò trên thân mình, da đầu và mặt. Ngoài ra, còn xuất hiện các vết đỏ hoặc hồng trên bệnh nhân da trắng và vết tăng sắc tố ở những bệnh nhân da đen. APD có thể gây ngứa dữ dội với sự phát triển của các vết trầy xước (hiện tượng Koebner). Nguồn gốc của những tổn thương APD chưa được biết rõ, có thể là do các phản ứng viêm da thứ phát bới sự có mặt của các chất độc urê huyết, lắng đọng acid uric và vết thương do trầy xước. Thay đổi mô học bao gồm sự xâm nhập vào lớp biểu bì của bạch cầu ưa kiềm, mụn cóc, acid uric và canxi hydroxyapatite và các u hạt viêm mãn tính. Điều trị APD thường gây ra khó khăn vì các tổn thương có thể tái phát và dễ hình thành sẹo. Chất bôi trơn, steroid, keratolytic, vitamin A, crytherapy, liệu pháp UVB, isoretinoin tại chỗ và đường uống là những phương pháp đã được thử nghiệm với mức độ thành công chưa ổn định.
Bệnh rối loạn porphyria (Porphyria Cutamea Tarda – PCT)
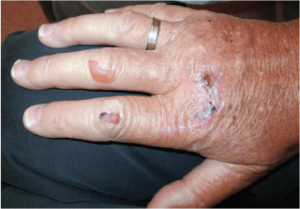
PCT xuất hiện ở bệnh nhân bệnh thận mạn dưới hình thức như các vết bỏng rộp trên lưng, bàn tay, bàn chân,(hình 7) đôi khi cũng xuất hiện trên mặt, đi kèm với tăng sắc tố (mảng xơ cứng). Nhiễm trùng thứ phát trên các tổn thương đó cũng có thể xảy ra, khi lành các tổn thương này sẽ tạo thành sẹo. PCT thể không liên tục xuất hiện ở khoảng 5% các bệnh nhân chạy thận, hình thức này có thể bùng phát do uống rượu, estrogen hoặc sắt; do nhiễm trùng mạn như viêm gan B, C hoặc HIV. Kết quả mô học cho thấy sự xuất hiện của IgG, C3 và các sợi mô liên kết ở lớp biểu bì, các mạch máu thấy các phần tử của phản ứng viêm. Rối loạn porphyrin giả (pseudoporphyria) được gây ra bởi thuốc (vd: amiodarone, tetracyclines và naproxen), biểu hiện rất giống PCT nhưng khác với PCT là nồng độ uro porphyrin là bình thường. Bảo vệ da trước ánh nắng mặt trời là yếu tố quyết định khi điều trị bệnh nhân PCT. Nồng độ uro porphyrin có thể hạ xuống khi lọc máu. Các biện pháp mạnh hơn làm giảm nồng độ uro porphyrin (vd: phẫu thuật tháo ống dẫn mật) không được khuyến cáo thực hiện thường xuyên. Bổ sung sắt hoặc estrogen cần được ngưng lại khi điệu trị PCT, bệnh nhần cần hạn chế vitamin B1 và tránh uống rượu.
 |
|
Hình 7. PCT ở bệnh nhân nam 50 tuổi đang chạy thận. Bỏng rộp xuất hiện trên những ngón tay thứ 2,3; vết thương trên mu bàn tay đang lành. |